شوق دانایی
یادگیری را رها نکنیم...شوق دانایی
یادگیری را رها نکنیم...شیمیِ پشت آزمایش معروف جوش شیرین و سرکه - سدیم استات و خواص آن - توضیحی مختصر دربارهی نمکهای آبدار
سلامی دوباره به همگی!
خب خب خب! دورهی بدون فعالیت تموم شد و قراره از این به بعد، هر چند وقت یک بار، یه مطلب جدید رو با هم بررسی کنیم!
این بار قراره بریم سراغ شیمی و آزمایش معروف جوش شیرین و سرکه:
خب، قبل از هر چیز، باید ببینیم جوش شیرین و سرکه، دقیقاً چی هستن!
سرکه در واقع محلول یک اسید آلی ( استیک اسید ) در آب هست. فرمول شیمیاییش C2H4O2 میشه که معمولاً به شکل CH3COOH مینویسیم تا بشه از روی فرمولش، ساختارش رو حدس زد. البته توی شیمی آلی، به اختصار، HOAc هم مینویسیم. ( مفید و مختصر! ) نام آیوپاک استیک اسید، اتانوییک اسید هست. استیک اسید خالص، یه بوی تند ( مثل بوی سرکه ) داره و بی رنگ هم هست. ساختار مولکولیش زیاد پیچیده نیست؛ یه کربوکسیلیک اسید عادیه که اگه کنجکاو بودین، میتونین ساختارش رو سرچ کنید. اگه کنجکاو هستید ولی حوصله ندارید ( واقعاً چرا؟! )، اون پایین عکس این ترکیبات رو گذاشتم که قشنگ با رسم شکل ببینید.
حالا جوش شیرین چیه؟
خب، جوش شیرین، بر خلاف اسمش، اصلاً هم شیرین نیست! ( یا اینکه درک من از شیرینی فرق داره ). در واقع، مزهش یه جوری تلخ مایل به شور هست. اگه بازم کنجکاو بودین، میتونین بخرین تست کنین. ( اینو دیگه نمیشد اون پایین بذارم! )
در واقع، مادهی موثر جوش شیرین، یک نمک معدنی به اسم سدیم بیکربنات هست؛ آیوپاک میگه بهتره که بگین سدیم هیدروژن کربنات.
اگه نمیدونید آیوپاک چیه، باید عرض کنم که اسم کامل IUPAC، در واقع International Union of Pure and Applied Chemistry هست که میشه اتحادیه بینالمللی شیمی محض و کاربردی. ایشون قراردادها، نامگذاریها و... رو تعیین میکنه. خب برگردیم به مطلب اصلی...
فرمول شیمیایی سدیم بیکربنات، NaHCO3 میشه. در واقع، با یک ترکیب یونی سروکار داریم که شبکهای منظم از یونهای +Na و -HCO3 با نسبت 1:1 هست. دلیل شور بودنش، یون سدیمه. تلخ بودنش هم ناشی از خصلت بازی ( قلیایی ) یون بیکربنات هست. البته بیکربنات هم میتونه به عنوان اسید عمل کنه و هم به عنوان باز ( به این دسته از مواد، آمفوتر میگیم )؛ اما خب توی آب خالص، اثر بازی بیکربنات غالبتر از اثر اسیدیشه.
احتمالاً دیدین که جوش شیرین رو برای تهیهی کیک و شیرینی و گاهاً نان و... استفاده میکنن. چرا؟
یون بیکربنات وقتی که وارد آب میشه، یه مقدار کربنیک اسید ( H2CO3 ) تولید میکنه. از اونجایی که کربنیک اسید ناپایداره، به آب و کربن دیاکسید تفکیک میشه. گاز کربن دیاکسید آزاد شده، میره تو دل خمیر و باعث میشه به اصطلاح وَر بیاد. مخمر نان هم برای تولید کربن دیاکسید استفاده میشه که البته اونجا به این سادگی نیست و واکنشهای بیشتری رخ میدن تا CO2 آزاد بشه. اینو چند وقت دیگه توی پست بعدی میگم!
خب حالا وقت چیه؟ واکنش!
استیک اسید میتونه با سدیم بیکربنات واکنش بده و سدیم استات به علاوهی آب و کربن دیاکسید تولید کنه:
CH3COOH + NaHCO3 ===> NaCH3COO + H2O + CO2
با عرض پوزش، به دلیل کمبود امکانات مجبور شدیم به جای فلش از علامت مساوی و بزگتر استفاده کنیم!
چون این واکنش در فاز محلول انجام میشه، یونهای ترکیبات یونیِ محلول، به صورت آزاد و مستقل وجود دارن و دیگه خبری از شبکهی یونی نیست. یعنی در ابتدا، یونهای سدیم و یونهای بیکربنات آزاد داریم. سدیم در واقع نقش هویج رو بازی میکنه! ( اینجا اصطلاحاً بهش میگیم یون ناظر یا تماشاگر. ) واکنش اصلی، بین استیک اسید و یون بیکربنات رخ میده. این واکنش، از نوع اسید و باز هست که استیک اسید به عنوان اسید، و بیکربنات به عنوان باز عمل میکنه. در اثر این فرایند، یه +H از استیک اسید به بیکربنات منتقل میشه. حالا چی تولید میشه؟ درسته! یون استات ( -CH3COO یا همون -OAc ) و کربنیک اسید. بعدش چی میشه؟ بله، باز هم درسته! کربنیک اسید به دلیل ناپایداریش تفکیک میشه و آب و کربن دیاکسید تولید میکنه. در نهایت، یونهای آزاد استات رو داریم، همینطور یونهای آزاد سدیم و صد البته آب. کربن دیاکسید هم به صورت حباب از محلول خارج میشه. اگه آزمایش رو انجام داده باشین، متوجه شدین که کف تولید میشه. این همون CO2 هست که به صورت حبابهای ریز آزاد شده و شبیه به کف شده. دیدید که یون سدیم به صورت مستقیم در واکنش نقشی نداشت و فقط حضور داشت که محلول از نظر بار الکتریکی کل، خنثی باقی بمونه.
استوکیومتری واکنش بین بیکربنات و استیک اسید، 1:1 هست. یعنی یک مول استیک اسید با یک مول سدیم بیکربنات واکنش میده. معنیش این میشه که اگه استیک اسید خالص داشته باشین، 60 گرم از اون میتونه با 84 گرم سدیم بیکربناتِ خالص واکنش بده. حتماً حواستون هست که سرکه، فرم خالص استیک اسید نیست و همینطور، جوش شیرین هم سدیم بیکربنات خالص نیست!
سدیم استات و خواص آن:
همونطور که دیدیم، سدیم استات یکی از فراوردههای واکنش بود. البته اگه محلول رو به همون شکل بذاریم، طبیعتاً یونهای سدیم و یونهای استات آزاد رو خواهیم داشت. برای رسیدن به سدیم استات، باید محلول یواش یواش تبخیر بشه و اگه ناخالصی نداشته باشین و ترکیبات رو با نسبت استوکیومتری درست ریخته باشین، اگه خدا بخواد، ممکنه سدیم استات ته ظرف رسوب کنه. البته انحلالپذیریش نسبتاً بالاست و نیازه که مقدار زیادی از محلول تبخیر بشه. اگه درصد خلوص مواد رو ندارید و نمیدونید ترکیبات رو با چه نسبتی بریزید، بهتره که سرکه رو اضافه بریزید تا ناخالصی محصولتون کم بشه. مثلاً یه مقدار مشخص جوش شیرین حل کنید و اینقدر سرکه بریزید که واکنش تموم بشه و دیگه حباب نکنه. بعد، جهت اطمینان بازم سرکه بریزید! از سرکهی سفید استفاده کنید که ناخالصیش کمتر باشه.
البته توصیهی من اینه که سعی نکنید از این روش سدیم استات بسازید. به زحمت و وقتش نمیارزه و آخرشم اون چیزی که میخواین درست نمیشه. حتی اگه هم بتونید درست کنید، دلتون نمیاد کاریش کنید و مثل من میذارید یه گوشه و هر وقت که چشمتون بهش میخوره، میگید هعییی جوونی یادت بخیر!
خب حالا این سدیم استات اصلاً چی هست و چه خواصی داره؟
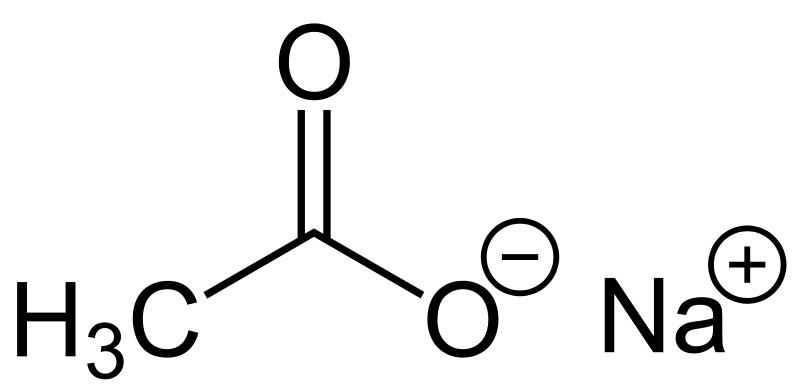
سدیم استات، یک ترکیب یونی هست که معمولاً به دو شکل وجود داره: بدون آب و آبدار. نمک بدون آب، فرمولش NaOAc هست؛ اما نمک آبدارش معمولاً سهآبهس و فرمولش NaOAc.3H2O میشه.
نمکهای آبدار اینطوری نیستن که خیس باشن یا اینکه فشار بدید مثل اسفنج آب ازشون خارج بشه! در واقع، مولکولهای آب هنگام تشکیل رسوب، همراه با یونها وارد شبکه میشن. یا به یونها میچسبن، یا توی فضاهای خالی بلور خودشونو جا میکنن و یا اینکه یونها رو تهدید میکنن که اگه نذارن باهاشون بیان توی شبکهی بلور، یا خودشون یا اونها رو میکشن!
تعداد آبهای نوشته شده در فرمول، در واقع نسبت تعداد مولکولهای آب به یونها در شبکه رو میگه. مثلاً اینجا به ازای هر یون سدیم، یک یون استات و سه مولکول آب داریم. این تعداد، بسته به اینکه یونها چی باشن، میتونه فرق کنه. حتی یک ترکیب خاص، میتونه تعداد مختلفی از مولکولهای آب رو در خودش جا بده و مثلاً از اون نمک، سهآبه، پنجآبه و... داشته باشیم. بعضی ترکیبها یکآبه هستن؛ بعضیا حتی 10 آبه و بیشتر. مثلاً سدیم سولفات میتونه به شکل Na2SO4.10H2O وجود داشته باشه.
نمکهای آبدار، خیلی توی طبیعت پیدا میشن و خیلی از زاجها، سنگهای قیمتی و... آبدار هستن. یک مثال خیلی معروف از نمکهای آبدار، کات کبود هست. کات کبود، همون مس سولفات پنجآبه با فرمول CuSO4.5H2O هست که خب رنگش آبیه. مس سولفات خشک ( بدون آب )، یه پودر بی رنگ هست. نکتهی جالب دربارهی مس سولفات اینه که تبدیل نمک آبدار به بدون آبش، برگشتپذیره. یعنی اینکه شما اگه کات کبود رو حرارت بدین، آبش به شکل بخار خارج میشه و سدیم سولفات بدون آب و بی رنگ جا میمونه. حالا اگه روی همین، چند قطره آب بریزید، جذبش میکنه و دوباره آبی میشه! دقت کنید که فقط بعضی از نمکهای آبدار این خاصیت رو دارن و اکثراً اینطور نیستن.
دربارهی نمکهای آبدار، این نکتهی آخر رو هم بگم که خیلیاشون فرم بدون آب رو اصلاً ندارن! یعنی وجود مولکول آب در شبکهشون لازمه و اگه نباشه، به خاطر ناپایداری، شبکه تشکیل نمیشه یا بلافاصله متلاشی میشه. این موارد بیشتر برای ترکیباتی با یونهای بزرگ یا یونهای با سایز خیلی متفاوت پیش میاد. اینجا در واقع مولکولهای آب فضاهای خالی رو پر میکنن تا یونها قشنگ روی هم چیده بشن؛ یا اینکه آب مثل چسب عمل میکنه و یونها رو به هم میچسبونه. پس خیلی جاها، حضور آب در شبکه لازمه و اونقدرها هم که فکر میکردید، آب چیز اضافهای نیست. پس در مصرف آب صرفهجویی کنید! خیلی هم ربط داشت!
برگردیم به خواص سدیم استات...
سدیم استات بدون آب، معمولاً یه پودر سفید رنگه. سدیم استات سهآبه، اگه خوب رسوب داده بشه و ناخالصی نداشته باشه، بلوری و بی رنگه.
سدیم استات رو معمولاً به عنوان افزودنی با طعم سرکه نمکی، به مواد غذایی مثل چیپس و بادام زمینی اضافه میکنن. احتمالاً بعد از خوردن بادام زمینی سرکه نمکی، متوجه یه پودر سفید و ترشِ باقی مونده تهِ بستهبندی شده باشید. البته روی خود بادام زمینیها هم دیده میشه. این پودر، همون سدیم استاته. مزهی نمکش به خاطر یون سدیم، و مزهی سرکهش به خاطر یون استاته. کیا فکر میکردن اون پودره نمکه؟
البته این رو با پودری که روی بعضی لواشکها هست قاطی نکنید! اونا سیتریک اسیده.
دربارهی خواص سدیم استات عرض کنم که یه چیز دیگه هم هست...
نمک سهآبهش ( که گفتم بلوری و بیرنگه )، اگه خالص باشه، خیلی ظاهرش به یخ شبیهه؛ از این یخ خوشگل بی رنگا!
به دلیل حضور یون استات، این ماده میتونه مشتعل بشه و ما میتونیم خیلی راحت بسوزونیمش. حالا یه لحظه تصور کنید... یخی که شعلهور بشه!
این یه آزمایش نسبتاً معروفه که بهش Hot Ice میگن.
البته البته! شاید توی عکسها دیده باشید که بعضی یخهای قطبی رو میسوزونن و آتیش بیرون میاد. اون قضیهش فرق داره و اون یخها، یخ واقعی هستن. دلیل شعلهور شدنشون اینه که مقدار خیلی زیادی گاز متان توی ساختار یخها گیر افتاده که به محض بیرون اومدن، مشتعل میشه.
خب امیدوارم که خوشتون اومده باشه و در کنار لذت بردن، کلی چیز باحال یاد گرفته باشید. اگه برای مطالب بعدی پیشنهادی دارید که موضوعشون چی باشه و چطور باشن، میتونید اون پایین تو بخش نظرات بنویسید ؛)
اینم از اون عکسهایی که قولشونو داده بودم:
استیک اسید:
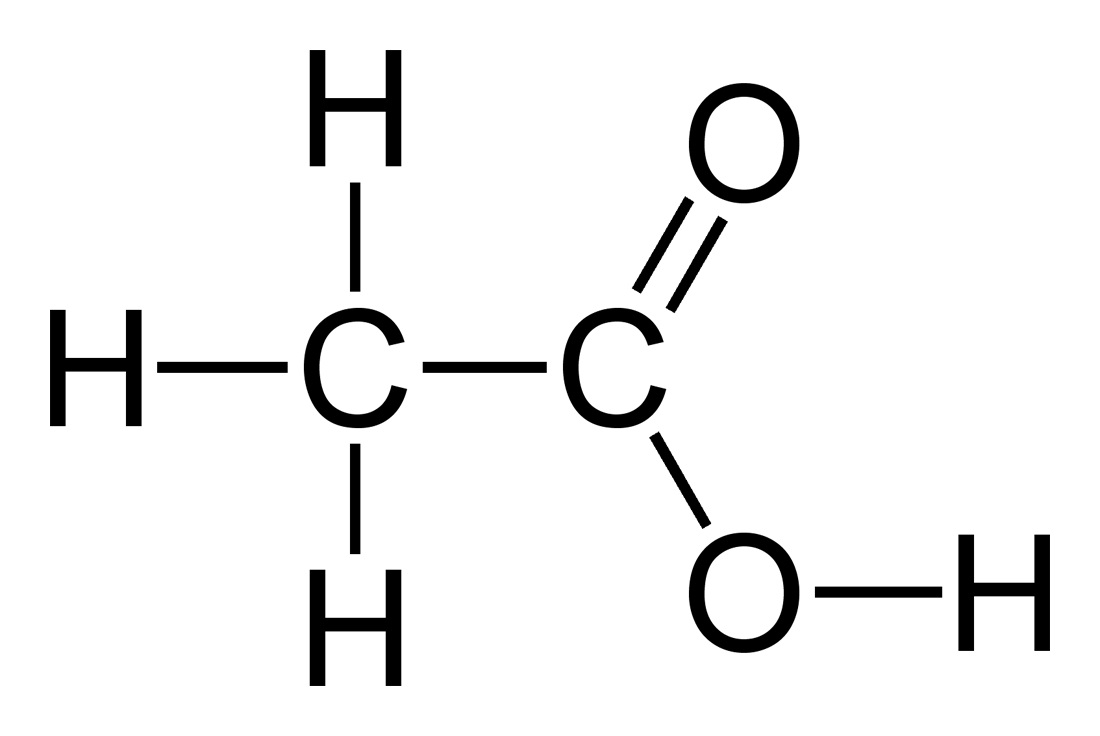
سدیم بیکربنات:
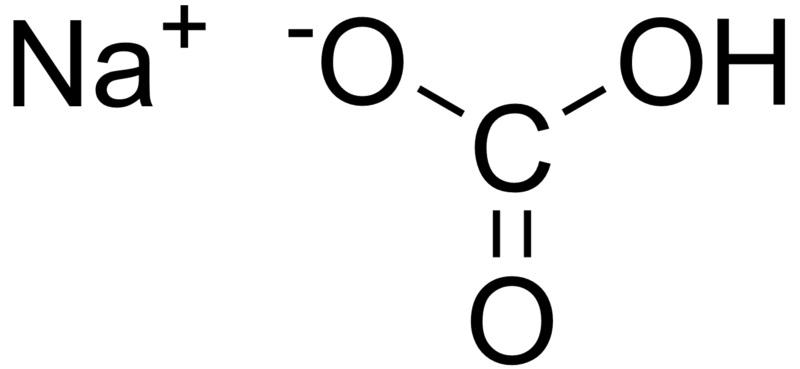
سدیم استات:
بدون عنوان...
سلام سلام! ببخشید که فعالیتم کمتر شده؛ آخه این چند وقت همهش درگیر درسهام هستم و واسه کارای دیگه زمان آزاد ندارم. البته این وضعیت همچنان هم ادامه داره. فقط خواستم بگم که صبر داشته باشین؛ به زودی اتفاقات خوبی میافته و سورپرایزها و مطالب جدیدی دارم که... بیخیال! اگه بگم مزهش میره! بعداً خودتون میفهمید...
ممکنه تا یه چند وقتی ( به قول معروف "اجالتاً"! ) مطلب و اینا نذارم و درگیر کارهای شخصی باشم. ولی بعدش چیزهایی خواهم گذاشت که کیف کنید! به احتمال زیاد مثل پستهای قبلی هم نخواهند بود و جذابتر و در کل بهتر هستن. خودتون میدونید، این قبلیا کلاً همهشون یه جوری بودن! موقع نوشتن بعضیاشون که سن و سطح دانشم کم بوده و مطالب رو خوب نمیگفتم. بعضیاشونم که بزرگتر شدم نوشتم، خوبنها! ولی خب احساس میکنم کسل کننده و حوصله سر برن.
اومده بودم یه سلامی بکنم و اینا رو بگم. فعلاً منتظر باشید...
میبینمتون
شکل فضایی مولکول
نکته: اگر دربارهی مبحث سوالی در ذهنتان ایجاد شد، به آدرس ایمیل من anosratollahi@gmail.com بفرستید.
یکی از مباحث آسان و شیرین در حوزهی پیوندهای کووالانسی، شکل سهبعدی مولکولهاست. بسیاری از مولکولها، شکلهای قابل پیش بینی دارند که میتوان آنها را حدس زد.
برای شکل فضایی پیوندها و مواد کووالانسی، 2 دیدگاه وجود دارد:
1- استفاده از اصول هندسی برای کاهش دافعه بین الکترونها و یافتن پایدارترین شکل
2- استفاده از تئوری اوربیتالهای هیبریدی و شکل اوربیتالها
استفاده از هیبرید اوربیتالها، مبحثی مفصل است و نیاز به دانستن اطلاعات بسیاری دربارهی ساختار اتم است. به صورت خلاصه، طبق اصل هایزنبرگ، امکان تعیین مکان و سرعت الکترون به طور همزمان ممکن نیست و فقط میتوان به صورت احتمالی نظر داد. اوربیتال، فضایی است که الکترون 90 درصد اوقات خود را در آن میگذراند. اگر معادلهی شرودینگر را حل کنیم، هر اوربیتال شکل خاصی را میگیرد (مثلاً s کروی و p دمبلی در سه جهت فضا است). اگر اتمی (مانند کربن) از بیش از یک نوع اوربیتال برای پیوند دادن استفاده کند، اوربیتالهای هیبریدی(ترکیبی) به وجود میآیند که دارای شکل و جهت گیری متفاوت هستند. این شکل و جهت گیری، شکل پیوندهای دور اتم و در نهایت، شکل مولکول را تحت تاثیر قرار میدهد.
یک تئوری آسانتر، استفاده از دافعهی الکترونی است.
برای این کار، ابتدا میتوانیم ساختار لوویس مولکول را کشیده و به روش زیر اقدام کنیم:
ابتدا باید شکل فضایی پیوندهای دور اتمها را حساب کنیم؛ برای این کار، تعداد قلمرو الکترونی آن را میشماریم. در تمام مولکولهای دو اتمی (متشکل از تنها دو عدد اتم(نه صرفاً دو نوع))، شکل مولکول خطی است. مثلاً میتوان به O2، HCl و ... اشاره کرد. دقت کنید که مثلاً H2O با اینکه دو نوع اتم دارد ولی دارای سه اتم است.
برای مولکولهایی که بیش از دو نوع اتم دارند، قضیه کمی متفاوت است.
ابتدا اتم مرکزی را تعیین میکنیم. (مثلاً در CO2، کربن اتم مرکزی است.)
سپس، به تعداد قلمروهای الکترونی اطراف اتم مرکزی توجه میکنیم. هر جفت الکترون ناپیوندی یک قلمرو الکترونی محسوب میشود. هر پیوند کووالانسی نیز، مستقل از مرتبه پیوند، یک قلمرو الکترونی است؛ یعنی مثلاً چه پیوند دوگانه باشد و چه یگانه، یک قلمرو حساب میشود.
مثلاً در CO2 همانگونه که از ساختار لوویسش پیداست، یک اتم کربن در وسط قرار دارد و با دو اتم اکسیژن، دو پیوند دوگانه ایجاد کرده است. در اطراف اتم کربن، دو قلمرو الکترونی وجود دارد: هیچ جفت ناپیوندی وجود ندارد ولی دارای دو پیوند است؛ هر پیوند یک قلمرو است پس در کل دو قلمرو وجود دارد.
اگر تعداد قلمروهای الکتروکی دور اتم مرکزی دو تا باشد، شکل مولکول خطی خواهد بود. پس CO2 ساختاری خطی دارد.
به عنوان مثال، مولکول دیگری که شکل خطی دارد، HCN است. برای تمرین، خودتان ساختار لوویس را کشیده، قلمروهای الکترونی را شمرده و توجیه کنید که چرا زاویه ایدهآل 180 درجه و ساختار مولکول خطی است.
در حالت کلی، افزایش زاویه بین قلمروهای الکترونی باعث پایدارتر شدن شکل مولکول میشود. علت این امر، دافعه بین الکترونها است.
پس مولکول دارای شکلی است که در آن، زوایای بین قلمروهای الکترونی، بیشترین حد ممکن باشد.
بر این اساس، برای تعداد مختلفی از قلمروهای الکترونی، اشکال مختلفی وجود دارد:
-اگر دو قلمرو وجود داشته باشد، دو قلمرو به صورت خطی و با زاویه ایدهآل 180 درجه در اطراف اتم قرار میگیرند. (مثل CO2)
-اگر سه قلمرو وجود داشته باشد، سه قلمرو به صورت مثلثی مسطح و با زاویه ایدهآل 120 درجه در اطراف اتم قرار میگیرند. (مثل SO3)
-اگر چهارقلمرو وجود داشته باشد، چهار قلمرو به صورت چهاروجهی و با زاویه ایدهآل 109.5 درجه در اطراف اتم قرار میگیرند. (مثل CH4) برای شکل CH4، یک سهپایه شاخدار را در نظر بگیرید که تمام زوایا با هم برابرند.
-اگر پنج قلمرو وجود داشته باشد، پنج قلمرو به صورت دوهرمی با قاعده مثلثی با زوایای ایدهآل 120 و 90 درجه در اطراف اتم قرار میگیرند. (مثل PCl5) برای شکل PCl5، دو هرم مثلثی را فرض کنید که در قاعده با هم مشترکند. در واقع، سه کلر را به صورت کمربندی در اطراف فسفر هستند و دو اتم کلر از سطح مثلث به صورت قائم به بالا و پایین رفتند. به عنوان مثالی دیگر، فرض کنید P هستهی زمین باشد، دو اتم کلر قطبهای شمال و جنوب باشند و سه کلر دیگر بر روی استوا قرار داشته باشند.
همانطور که مشخص است، ساختار 5 قلمرویی از لحاظ سه بعدی قرینه نیست و موقعیت اتمهای کلر متفاوت است؛ به طوری که دو اتم دارای موقعیت محوری و سه اتم دارای موقعیت استوایی هستند. پیوندهای استوایی از پیوندهای محوری کوتاهتر و قویتر هستند. جفت الکترونهای ناپیوندی و اتمهای بزرگ و حجیم، موقعیت استوایی را ترجیح میدهند ولی اتمهایی با الکترونگاتیوی بالا، موقعیت محوری را ترجیح میدهند. علت این امر، نامتقارن بودن سه بعدی شکل و کمینه شدن نیروی دافعه است. دقت داشته باشید که در رقابت برای گرفتن موقعیت استوایی بین جفت الکترون ناپیوندی و اتم حجیم، جفت الکترون ناپیوندی ارجحیت دارد و به زورش میچربد!
-اگر شش قلمرو وجود داشته باشد، شش قلمرو به صورت دو هرمی با قاعده مربع و با زاویه ایدهآل 90 و 180 درجه در اطراف اتم قرار میگیرند. (مثل SF6) برای ساختار SF6، سه میلهی فرضی را در هر سه جهت فضا (طول، عرض و ارتفاع) در اتم گوگرد فرو کنید؛ سر و ته هر میله، یک اتم فلوئور وجود دارد. ساختار 6 قلمرویی ساختاری قرینه است.
-برای 7 قلمرو، ساختار دو هرمی با قاعده پنج ضلعی (همانند 5 قلمرو، نامتقارن است)، برای 8 قلمرو، ساختار ضد منشور مربعی و برای 9 قلمرو، ساختار منشور سه ضلعی سه کلاهکی است.
تا الآن، ساختارها را بدون در نظر گرفتن جفت ناپیوندی در نظر گرفتیم و مثالهایی را بررسی کردیم که در مرکزی آنها جفت الکترون ناپیوندی نداشته باشند.
حال، بیاییم برای هر ساختار دانه دانه اتمهای کناری را برداشته و به جای آنها جفت الکترون ناپیوندی بگذاریم و سپس شکل مولکول را بررسی کنیم.
در اینجا باید دقت داشت که برای بیان شکل مولکول، باید فقط اتمها را در نظر بگیریم و جفت الکترونهای ناپیوندی را با اینکه بر شکل بسیار موثر اند، در بیان شکل فضایی در نظر نمیگیریم. به بیانی دیگر:
-شکل فضایی: فقط جهت گیری اتمها را در نظر می گیریم.
-آرایش فضایی: علاوه بر جهت گیری اتمها، جهت گیری جفت الکترونهای ناپیوندی را نیز در نظر میگیریم.
تمام مباحث گفته شده (دربارهی دو قلمرویی، سه قلمرویی و...) مربوط به آرایش فضایی بودند و شکل فضایی علاوه بر تعداد کل قلمروها، به تعداد جفت الکترونهای ناپیوندی نیز وابسته است.
برای بیان و رسم بهتر، اتم مرکزی را A، اتمهای کناری را B، و هر جفت الکترون ناپیوندی را E در نظر میگیریم. بر این اساس، تا کنون ساختار AB9، AB8، AB7، AB6، AB5، AB4، AB3، AB2 را بررسی کردیم که به ترتیب خطی، مثلثی مسطح، چهاروجهی، دو هرمی با قاعده مثلث، دو هرمی با قاعده مربع، دو هرمی با قاعده پنج ضلعی، ضد منشور مربعی و منشور سه ضلعی سه کلاهکی بودند. حال میخواهیم E را نیز اضافه کنیم:
قبل از هر چیز، باید بدانید که نیروی دافعه بین الکترونهای ناپیوندی بیشتر از الکترونهای پیوندی است؛ در واقع، ترتیب نیروی دافعه از زیاد به کم این گونه است: بین ناپیوندی و ناپیوندی - بین ناپیوندی و پیوندی - بین پیوندی و پیوندی. همچنین، هر چه دافعه بیشتر باشد، زاویه باز تر خواهد بود.
حالا میتوان به سراغ حالات مختلف رفت:
-برای AB2E: آرایش فضایی مانند AB3 (مثلثی مسطح) است اما شکل فضایی، خمیده است و زاویه بین دو پیوند، از 120 درجه کمتر است. (به دلیل دافعه بیشتر جفت الکترون ناپیوندی) مثل SO2.
-برای AB3E: آرایش فضایی مانند AB4 (چهاروجهی) است اما شکل فضایی، هرم با قاعده مثلثی است. (راس هرم، اتم مرکزی قرار دارد) زوایا نیز از 109.5 درجه کمتر اند. مثل NH3.
-برای AB2E2: آرایش فضایی چهاروجهی و مانند AB4 است ولی شکل فضایی، خمیده است. زوایا نیز از 109.5 درجه و همچنین از زوایای ساختار AB3E کمتر اند. مثل H2O.
-برای AB4E: آرایش فضایی مانند AB5 (دو هرم با قاعده مثلثی) است اما شکل فضایی، الاکلنگی است. (دو هرم با قاعده مثلثی را فرض کنید که یک اتم در موقعیت استوایی را برداشته و به جای آن، جفت الکترون ناپیوندی قرار دهیم) زوایا از 120 و 90 درجه کمتر اند. مثل SF4.
-برای AB3E2: آرایش فضایی دو هرمی با قاعده مثلثی و مانند AB5 است ولی شکل فضایی، T شکل است. (دو اتم در موقعیت استوایی را برداشته و به جای هر یک از آنها یک جفت الکترون ناپیوندی قرار میدهیم) زاویهها از 120 و 90 درجه و همچنین از زوایای AB4E کمتر اند. مثل IF3.
-برای AB2E3: آرایش فضایی همانند AB5، دو هرمی با قاعده مثلثی است ولی شکل فضایی، خطی و با زاویه 180 درجه است. (هر سه اتم استوایی را برداشته و یه جفت الکترون ناپیوندی قرار می دهیم). مثل XeF2.
-برای AB5E: آرایش فضایی مانند AB6 (دو هرم با قاعده مربعی) است اما شکل فضایی، هرم با قاعده مربعی است. (اتم مرکزی در وسط قاعدهی هرم است) و زوایا از 180 و 90 درجه کمترند. مثل BrF5.
-برای AB4E2: آرایش فضایی، دو هرمی با قاعده مربعی و مانند AB6 است ولی شکل فضایی، مربعی مسطح است و زوایا دقیقاً 90 و 180 درجه اند. (همان سه میلهای که فرو کردید را یادتان هست؟! دو سر یکی از آنها را به جای اتم، جفت الکترون ناپیوندی قرار دهید). مثل XeF4.
-برای AB6E: آرایش فضایی مانند AB7 (دو هرمی با قاعده پنج ضلعی) است اما شکل فضایی، هرم با قاعده پنج ضلعی است. (اتم مرکزی در وسط قاعده هرم قرار دارد). زوایا نیز از 144 و 90 و 72 درجه کمتر اند. مثل -(XeOF5) یا -(IF6)
-برای AB5E2: آرایش فضایی، دو هرمی با قاعده مربعی و مانند AB7 است ولی شکل فضایی، پنج ضلعی مسطح با زوایای 72 و 144 درجه است. (دو جفت الکترون ناپیوندی در نواحی محوری قرار دارند). مثل -(XeF5)
در نهایت، باید به دو نکته توجه کرد.
1- برخی اشکال فضایی توضیح داده نشدهاند؛ علتش آن است که مولکول پایداری با چنین شکلی پیدا نشده است.
2- برخی مولکولهایی که دارای قلمروهای زیادی هستند، از قواعد گفته شده پیروی نمیکنند. مثلاً انتظار میرود XeF6 با توجه به آنکه AB6E است، باید به شکل هرم با قاعده پنجضلعی باشد ولی شکل آن، هشت وجهی واپیچیده است.
اگر یک مولکول بیش از یک اتم مرکزی داشته باشد، باید شکل فضایی دور تک تک اتمهای مرکزی را در نظر گرفت و با توجه به آنها و ترکیب آنها به طوری که اشکال تغییر چندانی نکنند، شکل مولکول را رسم کرد.
نکتهی دیگر نیز آن است که بعضی مولکولها به علت ممانعت فضایی نمیتوانند پایدار باشند و در نتیجه در طبیعت یافت نشده و وجود نخواهند داشت.
اثرات شتاب بر سرعت
همه ی ما می دانیم که شتاب، محصول نیرو است؛ یعنی اگر بر جسمی نیروی خالصی وارد نشود، شتاب نیز نخواهد داشت. این، قانون اول نیوتون است.
توجه داشته باشید که شتاب دار بودن حرکت، فقط تغییر مقدار سرعت نیست؛ بلکه شتاب در کل معادل تغییرات سرعت است. یعنی اگر جسمی با تندی ثابت ( حرکت یکنواخت ) بر روی مسیری غیر از خط راست حرکت کند، باز هم جرکتش دارای شتاب است؛ چون در اینجا، جهت سرعت تغییر کرده است.
با توجه به این اصل، می توان اثر نیرو بر تغییر جهت سرعت و ایجاد شتاب را توجیه کرد.
نکته قابل توجه دیگر این است که شتاب و سرعت دو کمیت برداری هستند و تأثیرات شتاب بر سرعت می تواند متفاوت باشد. بیایید دقیق تر بررسی کنیم:
- اگر جهت شتاب دقیقاً همان جهت سرعت باشد، مقدار سرعت با توجه به شتاب افزایش می یابد و جهت سرعت تغییری نمی کند؛ یعنی مثلاً اگر شتاب 2 متر بر مجذور ثانیه باشد، مقدار سرعت در هر ثانیه 2 متر بر ثانیه بیشتر می شود. نمونه ی آن سقوط آزاد است.
- اگر جهت شتاب و سرعت دقیقاً مخالف هم باشند، مقدار سرعت با توجه به شتاب کاهش می یابد و جهت سرعت تغییری نمی کند؛ یعنی مثلاً اگر شتاب 2 متر بر مجذور ثانیه باشد، مقدار سرعت در هر ثانیه 2 متر بر ثانیه کمتر می شود. نمونه ی آن، حرکت جسم پرتابی به سمت بالا با وجود گرانش زمین است.
- اگر جهت شتاب دقیقاً بر جهت سرعت عمود باشد، مقدار سرعت تغییری نخواهد کرد و فقط جهت آن تغییر می کند. نمونه ی آن، حرکت سیارات به دور ستاره ها است. البتّه دقت داشته باشید که در چرخش سیارات، جهت شتاب نیز هر لحظه تغییر می کند ( همان گرانش ) و چون همیشه شعاع دایره در نقطه تماس بر خط مماس عمود است، همیشه جهت سرعت ( خط مماس ) بر جهت شتاب ( شعاع ) عمود خواهد بود. ولی اگر جهت شتاب تغییری نکند، فقط جهت حرکت جسم را موازی با خود می کند و تمام.
- اگر جهت شتاب و جهت نیرو دارای زاویه ای غیر از موارد بالا باشد، هم مقدار سرعت و هم جهت سرعت تغییر می کند. هر چه مقدار این زاویه از 0 یا 180 درجه به سمت 90 درجه میل کند، میزان تغییرات جهت سرعت بیشتر و میزان تغییرات مقدار سرعت کمتر خواهد بود.
شتاب در زاویه 0 درجه، فقط مقدار سرعت را بیشتر می کند. با افزایش این زاویه، تأثیر آن بر جهت سرعت بیشتر و تأثیر آن بر مقدار سرعت کمتر می شود. وقتی زاویه به 90 درجه می رسد، مقدار سرعت تغییری نمی کند و فقط جهت سرعت تغییر می کند. با افزایش این زاویه و حرکت آن به سمت 180 درجه، از میزان تغییرات جهت سرعت کاسته شده و تغییرات مقدار سرعت به سوی منفی بیشتر خواهد شد.
توجه داشته باشید که هرچه مقدار شتاب بیشتر شود، تأثیر آن هم بر جهت و هم بر مقدار سرعت بیشتر خواهد شد. ( تأثیر مستقیم )
در کل، اگر شتاب تداوم داشته باشد و جهت آن تغییری نکند، در نهایت جهت سرعت را موازی با جهت خود خواهد کرد.
رابطه هرون
سلام. واقعاً ببخشید یه مدّت نبودم؛ واقعاً کار داشتم.
شاید برای شما هم پیش آمده باشد که بخواهید مساحت مثلثی را حساب کنید ولی ارتفاع آن را نداشته باشید و یا ارتفاع آن با استفاده از طول ضلع و توابع مثلثاتی به دست نیاید. در این صورت چه باید کرد؟
اوّل آنکه باید اندازه تمام اضلاع را داشته باشید ( یا آن را از فرض های مسئله استخراج کرده باشید )؛ چون نسبت آنها تأثیر مستقیم بر روی زوایا دارد.
سپس، P را به دست می آورید که برابر با نصف محیط مثلث است؛ یعنی مثلاً اگر طول اضلاع a و b و c باشند: P=(a+b+c)/2
حال، با استفاده از P می توانید مساحت مثلث را طبق رابطه زیر حساب کنید:
S2=P(P-a)(P-b)(P-c)
که به راحتی می توانید از دو طرف رادیکال بگیرید ( چون تمام جملات مثبت هستند، ریشه منفی معنی پیدا نمی کند. )
رابطه بالا، به رابطه هرون معروف است که از آن برای به دست آوردن مساحت مثلث و فقط با استفاده از اندازه اضلاع استفاده می کنند. برای شکل های دیگر نیز می توانید آنها را تقسیم بندی کرده و به مثلث های کوچکتر تقسیم کنید و در آخر، مساحت تمام مثلث ها را با هم جمع کنید.
امیدوارم موفق و پیروز باشید.
آمینو اسید ها
آمینو اسید ها یا اسید های آمینه، انواع گسترده ای دارند و در ساختار پروتئین وجود دارند. به طور کلّی، هر آمینو اسید حدّاقل C2H4NO2 دارد که یک ساختار است و یک سر آن برای پیوند یگانه باز است. این ساختار به شکل زیر است:
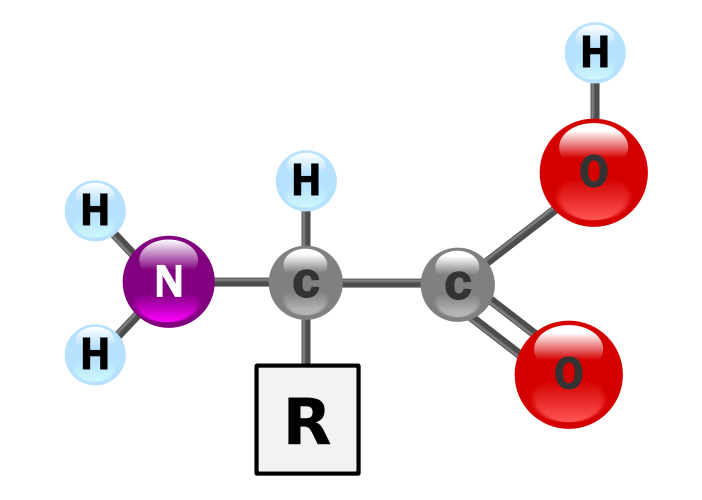
که در اینجا R همان سر آزاد است. ساده ترین آمینو اسید گلیسین است که سر آزاد به یک هیدروژن وصل شده است. البتّه این را با گلیسیرین با فرمول شیمیایی C3H8O3 اشتباه نگیرید. یک نوع آمینو اسید دیگر نیز به نام آلانین وجود دارد که به سر آزاد CH3 وصل شده است. پروتئین ها نیز از چند رشته ی صاف و مارپیچ از آمینو اسید ها تشکیل شده اند. البته آمینو اسید ها می توانند به صورت دیگری هم باشند؛ در آن صورت H قسمت OH برداشته می شود و کربن با یکی از اکسیژن ها پیوند دوگانه و با دیگری پیوند یگانه ایجاد می کند که اکسیژنی که پیوند یگانه با کربن دارد، دارای بار منفی می شود و هیدروژن برداشته شده به N می چسبد و N دارای چهار پیوند می شود؛ پس بار نیتروژن مثبت می شود و منفی بودن اکسیژن را جبران می کند. نام آمینو اسید به خاطر NH2 سر آن است و ریشه ی آن به آمونیاک NH3 و آمونیوم NH4+ بر می گردد.
پلاسما
پلاسما حالت فیزیکی چهارم ماده است. سه حالت دیگر، جامد، مایع و گاز هستند. پلاسما تنها حالتی از ماده است که از خود درخشش نشان می دهد و منبع نور است. ماده ای که همه یا بخش بسیار زیاد و قابل توجّهی از آن به صورت یون مثبت است و الکترون های از دست داده شده در ماده وجود دارد، پلاسما نام دارد. از پلاسما ها می توان به آتش و جرقه اشاره کرد که جرقه حالت پلاسمای هوا است. معمولاً گاز ها به صورت پلاسما در می آیند. پلاسما حالت چندان پایداری از ماده نیست؛ چون اتم های ماده می توانند الکترون ها را دوباره جذب کنند و ماده به حالت جامد، مایع یا گاز در می آید که در اکثر مواقع گاز است. جالب است که بدانید بیش از 99 درصد جهان به صورت پلاسما است. همچنین گاز موجود در لامپ های کم مصرف یا مهتابی در حالت روشن به صورت پلاسما است. معمولاً از حالت پلاسمای گاز های نجیب مانند نئون و زنون برای روشنایی استفاده می کنند. شیوه ی کار این لامپ ها این گونه است که الکتریسیته وارده تقویت می شود و ولتاژ آن تا حدّ زیادی بالا می رود و باعث می شود که گاز موجود در لامپ یونیزه شده و به صورت پلاسما درآید؛ در این صورت گاز درخشش خواهد داشت و لامپ نور تولید می کند. با قطع جریان برق، عمل یونیزه کردن گاز به اتمام می رسد و پلاسما دوباره به حالت گاز در می آید.
آلکان ها و الکل های مشتقات آنها
آلکان ها نوعی از هیدروکربن ها هستند که فقط از اتم های کربن و هیدروژن تشکیل شده اند. در آلکان ها، هر اتم کربن از هر چهار طرف یک پیوند دارد و سیر شده است. ساختار مولکولی آنها به گونه ای است که یک ردیف کربن توسط هیدروژن ها محاصره شده اند. فرمول اتمی آنها CnH2n+2 است. گاز های متان(CH4)، اتان(C2H6)، پروپان(C3H8)، بوتان(C4H10)، پنتان(C5H12)، هگزان(C6H14)، هپتان(C7H16)، اکتان(C8H18) و... جزو آلکان ها هستند. مانند تصویر زیر:

حالا فرض کنیم که در آلکان ها یک H را برداریم و به جای آن یک عامل OH قرار دهیم؛ آنگاه الکل هایی مانند متانول(CH3OH)، اتانول(C2H5OH)، پروپانول(C3H7OH)، بوتانول(C4H9OH)، پنتانول(C5H11OH)، هگزانول(C6H13OH)، هپتانول(C7H15OH)، اکتانول(C8H17OH) و... به وجود می آیند که با متانول و اتانول سروکار بیشتری داریم. متانول بی رنگ بوده و از چوب درختان یا واکنش کربن مونو اکسید با گاز هیدروژن ساخته می شود و اتانول بی رنگ است و از میوه ها یا واکنش آب با اتیلن ساخته می شود. متانول سوخت خوبی است که شعله ی آن بی رنگ است. اتانول از متانول بهتر می سوزد امّا کاربردهای دیگری نیز دارد؛ از اتانول برای ضدّ عفونی کردن استفاده می شود. همچنین در تولید مشروبات الکلی اتانول به کار می برند. توجّه داشته باشد که خوردن متانول بسیار خطرناک است. وقتی متانول وارد بدن می شود، آنزیمهای دهیدروژناز روی آن عمل کرده و فرمالدهید(CH2O) و پس از آن فرمیک اسید تولید می کند که باعث کوری یا حتّی مرگ می شود. فرمالدهید گازی با بوی تند و جزو گاز های گلخانه ای است. همچنین این گاز سرطان زا و خطرناک است.
یه روش ساده برای پیدا کردن مرکز دایره!
- یه خط توی دایره می کشیم که بالا های دایره باشه(مهم نیست کجا باشه).
- حالا به کمک گونیا یا هر چیزی که بشه باش زاویه ی راست کشید، دو خط عمود به اون خط از دو سر خط، بکشید.
- حالا یه خط بین سر اون دو خط بکشید. در این صورت یه مستطیل به وجود میاد.
- فقط کافیه که دو قطر مستطیل رو به هم وصل کنید.
- نقطه ای قطر های مستطیل به هم می رسند، مرکز دایرست.
- حالا اگه دوست داشتین، می تونین بقیّه خط ها غیر از دایره و مرکزشو پاک کنین.
دانلود انیمیشن پیدا کردن مرکز دایره
یک نکته ی مهم!
چگونه با کاغذ های باطله مقوّا بسازیم؟
خوشامد
به نام خداوند بخشنده ی مهربان
این وبلاگ به منظور درج مطالب علمی جهت استفاده ی دوستان عزیز و سرگرمی می باشد. امیدوارم مطالب این وبلاگ مورد استفاده ی شما عزیزان قرار گیرد. همواره پذیرای انتقادات و پیشنهادات شما خواهم بود. آریا نصرت اللهی 1393/8/13