شوق دانایی
یادگیری را رها نکنیم...شوق دانایی
یادگیری را رها نکنیم...آمینو اسید ها
آمینو اسید ها یا اسید های آمینه، انواع گسترده ای دارند و در ساختار پروتئین وجود دارند. به طور کلّی، هر آمینو اسید حدّاقل C2H4NO2 دارد که یک ساختار است و یک سر آن برای پیوند یگانه باز است. این ساختار به شکل زیر است:
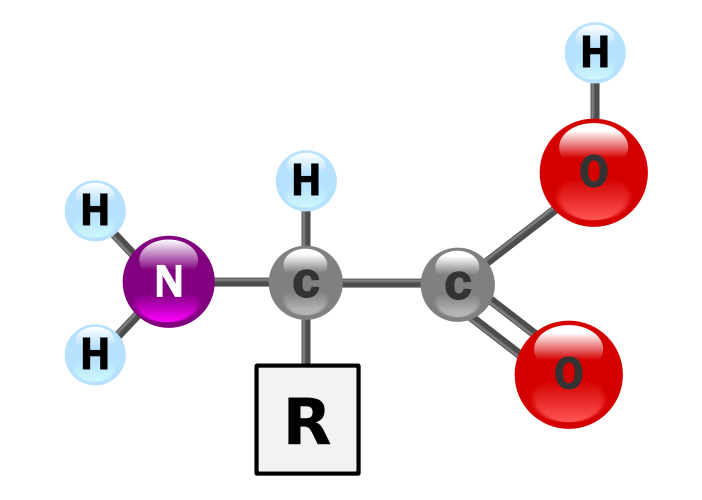
که در اینجا R همان سر آزاد است. ساده ترین آمینو اسید گلیسین است که سر آزاد به یک هیدروژن وصل شده است. البتّه این را با گلیسیرین با فرمول شیمیایی C3H8O3 اشتباه نگیرید. یک نوع آمینو اسید دیگر نیز به نام آلانین وجود دارد که به سر آزاد CH3 وصل شده است. پروتئین ها نیز از چند رشته ی صاف و مارپیچ از آمینو اسید ها تشکیل شده اند. البته آمینو اسید ها می توانند به صورت دیگری هم باشند؛ در آن صورت H قسمت OH برداشته می شود و کربن با یکی از اکسیژن ها پیوند دوگانه و با دیگری پیوند یگانه ایجاد می کند که اکسیژنی که پیوند یگانه با کربن دارد، دارای بار منفی می شود و هیدروژن برداشته شده به N می چسبد و N دارای چهار پیوند می شود؛ پس بار نیتروژن مثبت می شود و منفی بودن اکسیژن را جبران می کند. نام آمینو اسید به خاطر NH2 سر آن است و ریشه ی آن به آمونیاک NH3 و آمونیوم NH4+ بر می گردد.
پلاسما
پلاسما حالت فیزیکی چهارم ماده است. سه حالت دیگر، جامد، مایع و گاز هستند. پلاسما تنها حالتی از ماده است که از خود درخشش نشان می دهد و منبع نور است. ماده ای که همه یا بخش بسیار زیاد و قابل توجّهی از آن به صورت یون مثبت است و الکترون های از دست داده شده در ماده وجود دارد، پلاسما نام دارد. از پلاسما ها می توان به آتش و جرقه اشاره کرد که جرقه حالت پلاسمای هوا است. معمولاً گاز ها به صورت پلاسما در می آیند. پلاسما حالت چندان پایداری از ماده نیست؛ چون اتم های ماده می توانند الکترون ها را دوباره جذب کنند و ماده به حالت جامد، مایع یا گاز در می آید که در اکثر مواقع گاز است. جالب است که بدانید بیش از 99 درصد جهان به صورت پلاسما است. همچنین گاز موجود در لامپ های کم مصرف یا مهتابی در حالت روشن به صورت پلاسما است. معمولاً از حالت پلاسمای گاز های نجیب مانند نئون و زنون برای روشنایی استفاده می کنند. شیوه ی کار این لامپ ها این گونه است که الکتریسیته وارده تقویت می شود و ولتاژ آن تا حدّ زیادی بالا می رود و باعث می شود که گاز موجود در لامپ یونیزه شده و به صورت پلاسما درآید؛ در این صورت گاز درخشش خواهد داشت و لامپ نور تولید می کند. با قطع جریان برق، عمل یونیزه کردن گاز به اتمام می رسد و پلاسما دوباره به حالت گاز در می آید.
آلکان ها و الکل های مشتقات آنها
آلکان ها نوعی از هیدروکربن ها هستند که فقط از اتم های کربن و هیدروژن تشکیل شده اند. در آلکان ها، هر اتم کربن از هر چهار طرف یک پیوند دارد و سیر شده است. ساختار مولکولی آنها به گونه ای است که یک ردیف کربن توسط هیدروژن ها محاصره شده اند. فرمول اتمی آنها CnH2n+2 است. گاز های متان(CH4)، اتان(C2H6)، پروپان(C3H8)، بوتان(C4H10)، پنتان(C5H12)، هگزان(C6H14)، هپتان(C7H16)، اکتان(C8H18) و... جزو آلکان ها هستند. مانند تصویر زیر:

حالا فرض کنیم که در آلکان ها یک H را برداریم و به جای آن یک عامل OH قرار دهیم؛ آنگاه الکل هایی مانند متانول(CH3OH)، اتانول(C2H5OH)، پروپانول(C3H7OH)، بوتانول(C4H9OH)، پنتانول(C5H11OH)، هگزانول(C6H13OH)، هپتانول(C7H15OH)، اکتانول(C8H17OH) و... به وجود می آیند که با متانول و اتانول سروکار بیشتری داریم. متانول بی رنگ بوده و از چوب درختان یا واکنش کربن مونو اکسید با گاز هیدروژن ساخته می شود و اتانول بی رنگ است و از میوه ها یا واکنش آب با اتیلن ساخته می شود. متانول سوخت خوبی است که شعله ی آن بی رنگ است. اتانول از متانول بهتر می سوزد امّا کاربردهای دیگری نیز دارد؛ از اتانول برای ضدّ عفونی کردن استفاده می شود. همچنین در تولید مشروبات الکلی اتانول به کار می برند. توجّه داشته باشد که خوردن متانول بسیار خطرناک است. وقتی متانول وارد بدن می شود، آنزیمهای دهیدروژناز روی آن عمل کرده و فرمالدهید(CH2O) و پس از آن فرمیک اسید تولید می کند که باعث کوری یا حتّی مرگ می شود. فرمالدهید گازی با بوی تند و جزو گاز های گلخانه ای است. همچنین این گاز سرطان زا و خطرناک است.