شوق دانایی
یادگیری را رها نکنیم...شوق دانایی
یادگیری را رها نکنیم...شیمیِ پشت آزمایش معروف جوش شیرین و سرکه - سدیم استات و خواص آن - توضیحی مختصر دربارهی نمکهای آبدار
سلامی دوباره به همگی!
خب خب خب! دورهی بدون فعالیت تموم شد و قراره از این به بعد، هر چند وقت یک بار، یه مطلب جدید رو با هم بررسی کنیم!
این بار قراره بریم سراغ شیمی و آزمایش معروف جوش شیرین و سرکه:
خب، قبل از هر چیز، باید ببینیم جوش شیرین و سرکه، دقیقاً چی هستن!
سرکه در واقع محلول یک اسید آلی ( استیک اسید ) در آب هست. فرمول شیمیاییش C2H4O2 میشه که معمولاً به شکل CH3COOH مینویسیم تا بشه از روی فرمولش، ساختارش رو حدس زد. البته توی شیمی آلی، به اختصار، HOAc هم مینویسیم. ( مفید و مختصر! ) نام آیوپاک استیک اسید، اتانوییک اسید هست. استیک اسید خالص، یه بوی تند ( مثل بوی سرکه ) داره و بی رنگ هم هست. ساختار مولکولیش زیاد پیچیده نیست؛ یه کربوکسیلیک اسید عادیه که اگه کنجکاو بودین، میتونین ساختارش رو سرچ کنید. اگه کنجکاو هستید ولی حوصله ندارید ( واقعاً چرا؟! )، اون پایین عکس این ترکیبات رو گذاشتم که قشنگ با رسم شکل ببینید.
حالا جوش شیرین چیه؟
خب، جوش شیرین، بر خلاف اسمش، اصلاً هم شیرین نیست! ( یا اینکه درک من از شیرینی فرق داره ). در واقع، مزهش یه جوری تلخ مایل به شور هست. اگه بازم کنجکاو بودین، میتونین بخرین تست کنین. ( اینو دیگه نمیشد اون پایین بذارم! )
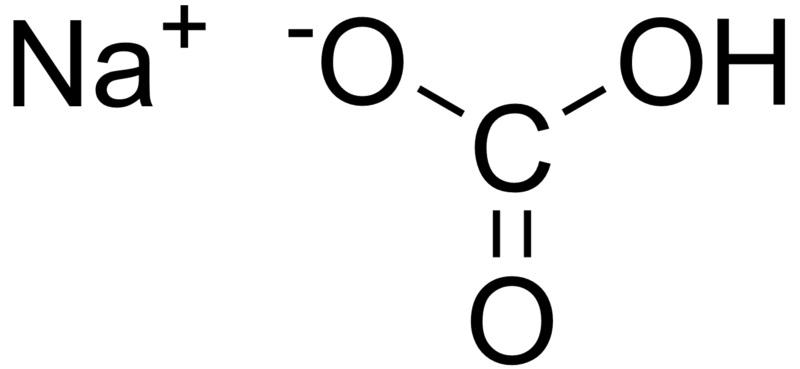
در واقع، مادهی موثر جوش شیرین، یک نمک معدنی به اسم سدیم بیکربنات هست؛ آیوپاک میگه بهتره که بگین سدیم هیدروژن کربنات.
اگه نمیدونید آیوپاک چیه، باید عرض کنم که اسم کامل IUPAC، در واقع International Union of Pure and Applied Chemistry هست که میشه اتحادیه بینالمللی شیمی محض و کاربردی. ایشون قراردادها، نامگذاریها و... رو تعیین میکنه. خب برگردیم به مطلب اصلی...
فرمول شیمیایی سدیم بیکربنات، NaHCO3 میشه. در واقع، با یک ترکیب یونی سروکار داریم که شبکهای منظم از یونهای +Na و -HCO3 با نسبت 1:1 هست. دلیل شور بودنش، یون سدیمه. تلخ بودنش هم ناشی از خصلت بازی ( قلیایی ) یون بیکربنات هست. البته بیکربنات هم میتونه به عنوان اسید عمل کنه و هم به عنوان باز ( به این دسته از مواد، آمفوتر میگیم )؛ اما خب توی آب خالص، اثر بازی بیکربنات غالبتر از اثر اسیدیشه.
احتمالاً دیدین که جوش شیرین رو برای تهیهی کیک و شیرینی و گاهاً نان و... استفاده میکنن. چرا؟
یون بیکربنات وقتی که وارد آب میشه، یه مقدار کربنیک اسید ( H2CO3 ) تولید میکنه. از اونجایی که کربنیک اسید ناپایداره، به آب و کربن دیاکسید تفکیک میشه. گاز کربن دیاکسید آزاد شده، میره تو دل خمیر و باعث میشه به اصطلاح وَر بیاد. مخمر نان هم برای تولید کربن دیاکسید استفاده میشه که البته اونجا به این سادگی نیست و واکنشهای بیشتری رخ میدن تا CO2 آزاد بشه. اینو چند وقت دیگه توی پست بعدی میگم!
خب حالا وقت چیه؟ واکنش!
استیک اسید میتونه با سدیم بیکربنات واکنش بده و سدیم استات به علاوهی آب و کربن دیاکسید تولید کنه:
CH3COOH + NaHCO3 ===> NaCH3COO + H2O + CO2
با عرض پوزش، به دلیل کمبود امکانات مجبور شدیم به جای فلش از علامت مساوی و بزگتر استفاده کنیم!
چون این واکنش در فاز محلول انجام میشه، یونهای ترکیبات یونیِ محلول، به صورت آزاد و مستقل وجود دارن و دیگه خبری از شبکهی یونی نیست. یعنی در ابتدا، یونهای سدیم و یونهای بیکربنات آزاد داریم. سدیم در واقع نقش هویج رو بازی میکنه! ( اینجا اصطلاحاً بهش میگیم یون ناظر یا تماشاگر. ) واکنش اصلی، بین استیک اسید و یون بیکربنات رخ میده. این واکنش، از نوع اسید و باز هست که استیک اسید به عنوان اسید، و بیکربنات به عنوان باز عمل میکنه. در اثر این فرایند، یه +H از استیک اسید به بیکربنات منتقل میشه. حالا چی تولید میشه؟ درسته! یون استات ( -CH3COO یا همون -OAc ) و کربنیک اسید. بعدش چی میشه؟ بله، باز هم درسته! کربنیک اسید به دلیل ناپایداریش تفکیک میشه و آب و کربن دیاکسید تولید میکنه. در نهایت، یونهای آزاد استات رو داریم، همینطور یونهای آزاد سدیم و صد البته آب. کربن دیاکسید هم به صورت حباب از محلول خارج میشه. اگه آزمایش رو انجام داده باشین، متوجه شدین که کف تولید میشه. این همون CO2 هست که به صورت حبابهای ریز آزاد شده و شبیه به کف شده. دیدید که یون سدیم به صورت مستقیم در واکنش نقشی نداشت و فقط حضور داشت که محلول از نظر بار الکتریکی کل، خنثی باقی بمونه.
استوکیومتری واکنش بین بیکربنات و استیک اسید، 1:1 هست. یعنی یک مول استیک اسید با یک مول سدیم بیکربنات واکنش میده. معنیش این میشه که اگه استیک اسید خالص داشته باشین، 60 گرم از اون میتونه با 84 گرم سدیم بیکربناتِ خالص واکنش بده. حتماً حواستون هست که سرکه، فرم خالص استیک اسید نیست و همینطور، جوش شیرین هم سدیم بیکربنات خالص نیست!
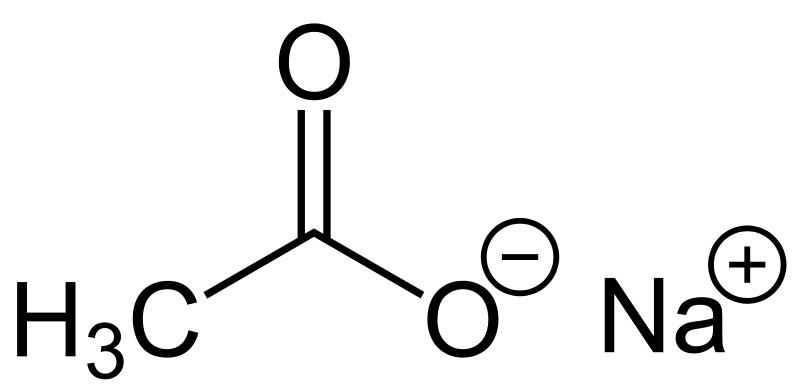
سدیم استات و خواص آن:
همونطور که دیدیم، سدیم استات یکی از فراوردههای واکنش بود. البته اگه محلول رو به همون شکل بذاریم، طبیعتاً یونهای سدیم و یونهای استات آزاد رو خواهیم داشت. برای رسیدن به سدیم استات، باید محلول یواش یواش تبخیر بشه و اگه ناخالصی نداشته باشین و ترکیبات رو با نسبت استوکیومتری درست ریخته باشین، اگه خدا بخواد، ممکنه سدیم استات ته ظرف رسوب کنه. البته انحلالپذیریش نسبتاً بالاست و نیازه که مقدار زیادی از محلول تبخیر بشه. اگه درصد خلوص مواد رو ندارید و نمیدونید ترکیبات رو با چه نسبتی بریزید، بهتره که سرکه رو اضافه بریزید تا ناخالصی محصولتون کم بشه. مثلاً یه مقدار مشخص جوش شیرین حل کنید و اینقدر سرکه بریزید که واکنش تموم بشه و دیگه حباب نکنه. بعد، جهت اطمینان بازم سرکه بریزید! از سرکهی سفید استفاده کنید که ناخالصیش کمتر باشه.
البته توصیهی من اینه که سعی نکنید از این روش سدیم استات بسازید. به زحمت و وقتش نمیارزه و آخرشم اون چیزی که میخواین درست نمیشه. حتی اگه هم بتونید درست کنید، دلتون نمیاد کاریش کنید و مثل من میذارید یه گوشه و هر وقت که چشمتون بهش میخوره، میگید هعییی جوونی یادت بخیر!
خب حالا این سدیم استات اصلاً چی هست و چه خواصی داره؟
سدیم استات، یک ترکیب یونی هست که معمولاً به دو شکل وجود داره: بدون آب و آبدار. نمک بدون آب، فرمولش NaOAc هست؛ اما نمک آبدارش معمولاً سهآبهس و فرمولش NaOAc.3H2O میشه.
نمکهای آبدار اینطوری نیستن که خیس باشن یا اینکه فشار بدید مثل اسفنج آب ازشون خارج بشه! در واقع، مولکولهای آب هنگام تشکیل رسوب، همراه با یونها وارد شبکه میشن. یا به یونها میچسبن، یا توی فضاهای خالی بلور خودشونو جا میکنن و یا اینکه یونها رو تهدید میکنن که اگه نذارن باهاشون بیان توی شبکهی بلور، یا خودشون یا اونها رو میکشن!
تعداد آبهای نوشته شده در فرمول، در واقع نسبت تعداد مولکولهای آب به یونها در شبکه رو میگه. مثلاً اینجا به ازای هر یون سدیم، یک یون استات و سه مولکول آب داریم. این تعداد، بسته به اینکه یونها چی باشن، میتونه فرق کنه. حتی یک ترکیب خاص، میتونه تعداد مختلفی از مولکولهای آب رو در خودش جا بده و مثلاً از اون نمک، سهآبه، پنجآبه و... داشته باشیم. بعضی ترکیبها یکآبه هستن؛ بعضیا حتی 10 آبه و بیشتر. مثلاً سدیم سولفات میتونه به شکل Na2SO4.10H2O وجود داشته باشه.
نمکهای آبدار، خیلی توی طبیعت پیدا میشن و خیلی از زاجها، سنگهای قیمتی و... آبدار هستن. یک مثال خیلی معروف از نمکهای آبدار، کات کبود هست. کات کبود، همون مس سولفات پنجآبه با فرمول CuSO4.5H2O هست که خب رنگش آبیه. مس سولفات خشک ( بدون آب )، یه پودر بی رنگ هست. نکتهی جالب دربارهی مس سولفات اینه که تبدیل نمک آبدار به بدون آبش، برگشتپذیره. یعنی اینکه شما اگه کات کبود رو حرارت بدین، آبش به شکل بخار خارج میشه و سدیم سولفات بدون آب و بی رنگ جا میمونه. حالا اگه روی همین، چند قطره آب بریزید، جذبش میکنه و دوباره آبی میشه! دقت کنید که فقط بعضی از نمکهای آبدار این خاصیت رو دارن و اکثراً اینطور نیستن.
دربارهی نمکهای آبدار، این نکتهی آخر رو هم بگم که خیلیاشون فرم بدون آب رو اصلاً ندارن! یعنی وجود مولکول آب در شبکهشون لازمه و اگه نباشه، به خاطر ناپایداری، شبکه تشکیل نمیشه یا بلافاصله متلاشی میشه. این موارد بیشتر برای ترکیباتی با یونهای بزرگ یا یونهای با سایز خیلی متفاوت پیش میاد. اینجا در واقع مولکولهای آب فضاهای خالی رو پر میکنن تا یونها قشنگ روی هم چیده بشن؛ یا اینکه آب مثل چسب عمل میکنه و یونها رو به هم میچسبونه. پس خیلی جاها، حضور آب در شبکه لازمه و اونقدرها هم که فکر میکردید، آب چیز اضافهای نیست. پس در مصرف آب صرفهجویی کنید! خیلی هم ربط داشت!
برگردیم به خواص سدیم استات...
سدیم استات بدون آب، معمولاً یه پودر سفید رنگه. سدیم استات سهآبه، اگه خوب رسوب داده بشه و ناخالصی نداشته باشه، بلوری و بی رنگه.
سدیم استات رو معمولاً به عنوان افزودنی با طعم سرکه نمکی، به مواد غذایی مثل چیپس و بادام زمینی اضافه میکنن. احتمالاً بعد از خوردن بادام زمینی سرکه نمکی، متوجه یه پودر سفید و ترشِ باقی مونده تهِ بستهبندی شده باشید. البته روی خود بادام زمینیها هم دیده میشه. این پودر، همون سدیم استاته. مزهی نمکش به خاطر یون سدیم، و مزهی سرکهش به خاطر یون استاته. کیا فکر میکردن اون پودره نمکه؟
البته این رو با پودری که روی بعضی لواشکها هست قاطی نکنید! اونا سیتریک اسیده.
دربارهی خواص سدیم استات عرض کنم که یه چیز دیگه هم هست...
نمک سهآبهش ( که گفتم بلوری و بیرنگه )، اگه خالص باشه، خیلی ظاهرش به یخ شبیهه؛ از این یخ خوشگل بی رنگا!
به دلیل حضور یون استات، این ماده میتونه مشتعل بشه و ما میتونیم خیلی راحت بسوزونیمش. حالا یه لحظه تصور کنید... یخی که شعلهور بشه!
این یه آزمایش نسبتاً معروفه که بهش Hot Ice میگن.
البته البته! شاید توی عکسها دیده باشید که بعضی یخهای قطبی رو میسوزونن و آتیش بیرون میاد. اون قضیهش فرق داره و اون یخها، یخ واقعی هستن. دلیل شعلهور شدنشون اینه که مقدار خیلی زیادی گاز متان توی ساختار یخها گیر افتاده که به محض بیرون اومدن، مشتعل میشه.
خب امیدوارم که خوشتون اومده باشه و در کنار لذت بردن، کلی چیز باحال یاد گرفته باشید. اگه برای مطالب بعدی پیشنهادی دارید که موضوعشون چی باشه و چطور باشن، میتونید اون پایین تو بخش نظرات بنویسید ؛)
اینم از اون عکسهایی که قولشونو داده بودم:
استیک اسید:
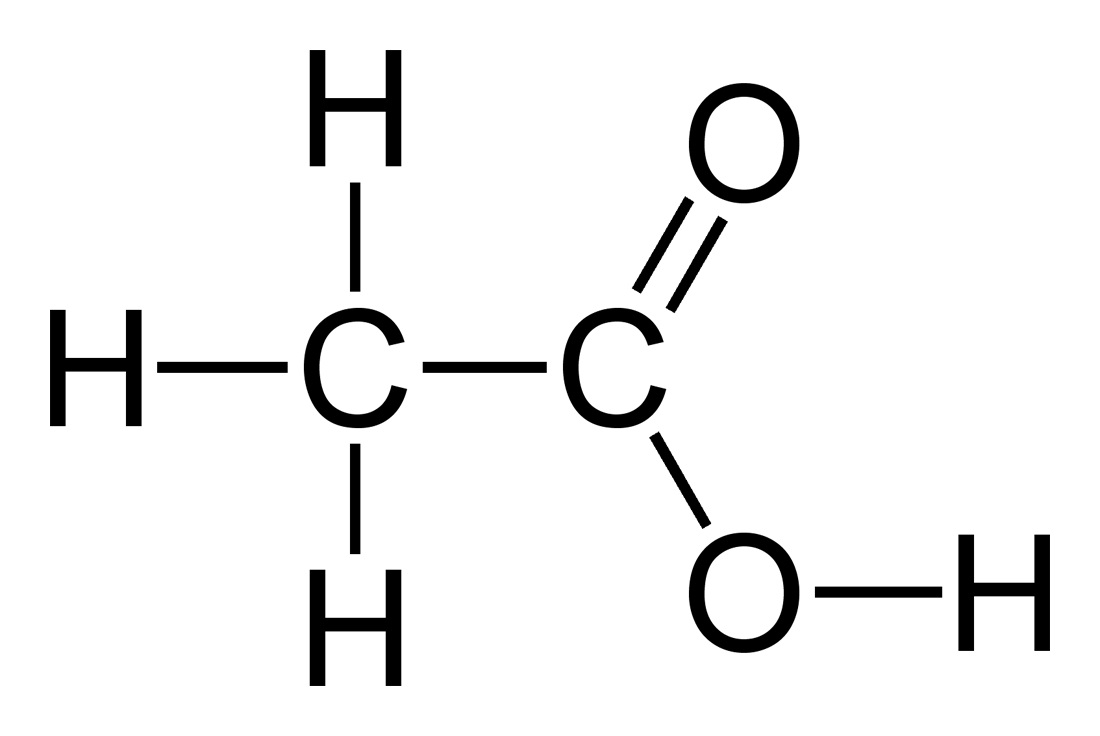
سدیم بیکربنات:
سدیم استات:
ای کاش 30 سال پیش هم آموزش اینگونه شیرین بود
درود بر دانشمند عزیز❤️
خدا حفظت کنه
عالی توضیح دادی درود
درود بر شما نخبه و تلاشگر
عالی
شیمی بسیار خوب تشریح شده
تشکر از متن و توضیح عالی درس شیمی
موفق باشی
ممنون از توضیحات تون استاد عزیز
قابل تحسین هستی
ممنون از شما دوست عزیز
توضیحات خیلی خوب بود
ممنون از نظر مثبت شما